Práticas de inspeção visual de equipamentos limpos
Principais conclusões:
- A inspeção visual é necessária para confirmar se o equipamento está livre de resíduos visíveis.
- “Visualmente limpo” é aceito, mas as definições variam se os procedimentos forem justificados.
- Superfícies diretas e indiretas exigem ferramentas para uma inspeção visual eficaz.
- Os métodos validados devem dar suporte à inspeção visual, garantindo a limpeza completa.
- Os limites de visibilidade definem a detecção de contaminação para uma inspeção consistente.
Visual Inspection Practices of Cleaned Equipment: Part I
Diretrizes regulatórias e compendiais exigem que os fabricantes confirmem que o equipamento do processo esteja visualmente limpo após uma operação de limpeza. Recentemente, uma pesquisa da Steris mostrou que as práticas de inspeção visual de equipamentos limpos diferem entre os fabricantes. Ao mesmo tempo, a pesquisa indicou que, embora as práticas e até mesmo a terminologia possam ser diferentes, isso pode ser aceito pelos reguladores, desde que os processos sejam bem documentados.
Primeiro, uma palavra sobre terminologia: muitas diretrizes regulatórias e documentos técnicos do setor usam termos diferentes para descrever a etapa de confirmação de que o equipamento do processo está visualmente limpo após a limpeza. Para os fins deste artigo, os autores usam o termo «inspeção visual». Outros termos comuns para esta etapa são «verificação visual» ou «exame visual». Observe que, neste caso, «inspeção visual» não se refere à verificação visual de partículas no produto acabado.
Trinta e nove (39) pessoas responderam à pesquisa, representando muitas empresas farmacêuticas e biofarmacêuticas europeias (27 empresas em 34 locais diferentes). Os fabricantes que responderam à pesquisa foram: 54% não estéreis (por exemplo, comprimido, líquido, produto combinado), 13% estéreis (por exemplo, biotecnologia, líquido e produto liofilizado), 26% vacinas, 5% dispositivos médicos, 2% outros (por exemplo, produção clínica inicial).
O Anexo Europeu 15 afirma que “uma verificação visual da limpeza é uma parte importante dos critérios de aceitação para validação da limpeza” (1). A inspeção visual é uma etapa crítica para confirmar a eficácia do equipamento do processo de limpeza após a limpeza. O critério de aceitação para inspeção visual é visualmente limpo. A inspeção visual deve incluir superfícies de contato direto e indireto do produto e exige que as superfícies do equipamento sejam visíveis. Quando isso não ocorre, pode ser necessário desmontar o equipamento para obter acesso ou utilizar ferramentas como espelhos, fontes de luz ou boroscópios (2, 3). Tecnologias modernas, como câmeras digitais capazes de avaliar a superfície, também podem ser exploradas para recipientes de grande volume, quando uma inspeção visual é desafiadora.
Visualmente limpo é o padrão mínimo esperado. No entanto, um critério de aceitação adicional, como o limite baseado na saúde, é aplicado (1-5). Portanto, um método analítico validado com sensibilidade abaixo do limite de limpeza deve ser periodicamente combinado a uma inspeção visual. Ao aplicar apenas a inspeção visual para determinar a limpeza do equipamento, deve-se estabelecer o limite no qual o produto é facilmente visível como resíduo (3, 6).
A inspeção visual é sempre realizada (na medida do possível) no final de um ciclo de limpeza concluído (7). A inspeção visual é uma observação ativa e qualitativa das superfícies de contato do produto para confirmar a ausência de resíduos e iniciar a produção do próximo lote (7). ICH Q7: O Guia de Práticas para Insumos Farmacêuticos Ativos afirma que: “12.76 … A inspeção visual pode permitir a detecção de contaminação grave concentrada em pequenas áreas que, de outra forma, poderiam passar despercebidas por amostragem e/ou análise”.
Voltando à pesquisa, 54% dos entrevistados realizam uma inspeção visual da superfície do equipamento quando ela está seca (Figura 1).
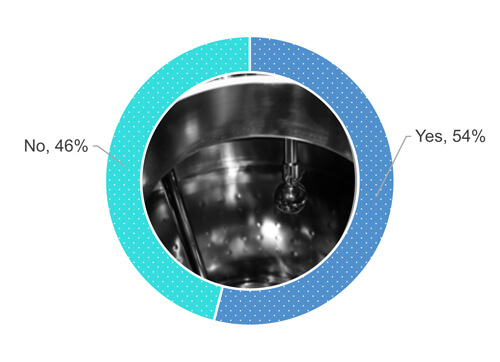
Figura 1 O procedimento da sua empresa exige que você inspecione visualmente a superfície do equipamento de processo após uma operação de limpeza quando a superfície estiver seca?
Alguns documentos técnicos da indústria sugerem que a inspeção visual deve ser realizada em uma superfície seca, quando possível, para evitar resultados falso-negativos (8,9):
- Orientação do Comitê de Insumos Farmacêuticos Ativos (10):
- “Após a realização dos procedimentos de limpeza, o equipamento deve ser seco para permitir a inspeção visual”.
- “Os critérios de aceitação para limpeza de equipamentos devem ser baseados em condições visuais de limpeza em condições secas e em um limite analítico”.
- Relatório Técnico da PDA nº 29: Pontos a considerar para a validação da limpeza (9): “Normalmente, as superfícies que são examinadas visualmente devem estar secas, pois isso representa a pior condição para a inspeção visual”.
É de conhecimento geral que, para alguns resíduos, a limpeza visual só pode ser alcançada quando a superfície está molhada, o que não ocorre mais quando a superfície seca.
O projeto do equipamento e os parâmetros do ciclo de limpeza podem levar à secagem das superfícies do equipamento, como ter a tubulação inclinada em direção ao ralo, ser autodrenável e o enxágue final realizado em altas temperaturas. Em alguns casos, o ar limpo insuflado no equipamento e no sistema de distribuição pode ajudar a atingir a secura nas superfícies (9).
Apesar desses parâmetros listados acima serem atendidos, gotículas ou umidade (“suor”) na superfície podem ser potencialmente observadas e podem ser aceitáveis se adequadamente justificadas.
Como mostra a Figura 1, 48% dos 54% que responderam “sim”, quando questionados se inspecionam visualmente as superfícies dos equipamentos quando totalmente secas (Figura 2). 24% dos 54% permitem alguma umidade parcial (por exemplo, gotas isoladas ou suor) nas superfícies durante uma inspeção visual do equipamento limpo (Figura 2). 19% dos 54% aceitam inúmeras gotas, mas não acúmulo de água. 9% dos 54% não definiram os requisitos de secura.
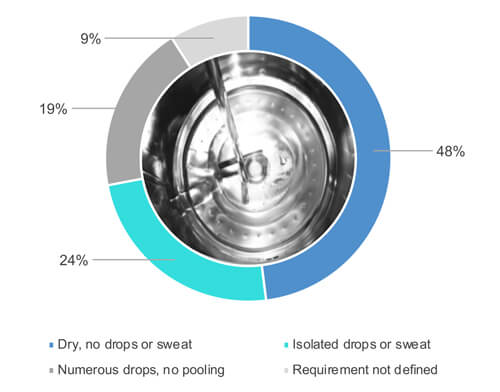
Figura 2 Qual é o requisito de secura para os equipamentos do processo após a conclusão do ciclo de limpeza?
Diferentes níveis de secura são aceitáveis se adequadamente justificados e corroborados por dados que demonstrem a ausência de impacto na inspeção visual pós-limpeza e na proliferação de biocarga durante o armazenamento limpo, por exemplo, instruções e formação robustas usando fotos para evitar desvios. Por fim, nenhum dos 54% dos fabricantes que inspecionam visualmente seus equipamentos quando as superfícies estão secas autoriza água parada ou acumulada nas superfícies dos equipamentos, conforme sugerido no guia de inspeções da FDA dos Estados Unidos (10): “…Por exemplo, o equipamento deve ser seco antes do armazenamento e, em nenhuma circunstância, deve-se permitir que água parada permaneça no equipamento após as operações de limpeza”.
O operador tem a responsabilidade considerável de decidir se as superfícies do equipamento estão visualmente limpas. Portanto, os operadores devem ser capazes de inspecionar visualmente todas as superfícies do equipamento. Caso não seja possível, devem estar disponíveis ferramentas adequadas ou avançadas para garantir uma tomada de decisão adequada (2, 3, 9, 11). A inspeção visual de um grande recipiente através de um visor é restritiva devido à superfície oculta. A EMA sugere que a capacidade de inspecionar visualmente o equipamento, como as distâncias observadas em campo, deve ser levada em consideração em um documento de perguntas e respostas (3), recomendando que as «instruções escritas especificando todas as áreas que requerem inspeção visual devem estar em vigor e os registros confirmem claramente que todas as inspeções foram concluídas». Por fim, os procedimentos detalhados e a formação sobre critérios visualmente limpos são obrigatórios para garantir a tomada de decisão correta. O nível de formação e qualificação para inspeção visual deve ser compatível com o risco de contaminação cruzada (3, 7, 9, 11).
No que diz respeito às fotos, 38% dos entrevistados definiram critérios de limpeza visual, adicionando também fotos e exemplos de status de limpeza (Figura 3). Quarenta e seis por cento confiam no entendimento do operador quanto à limpeza visual, juntamente com uma definição teórica de limpeza visual no procedimento. Por fim, 16% (3% e 13%) contam com a experiência e a formação do operador (com suporte específico ou imagens) de uma superfície visualmente limpa (Figura 3).
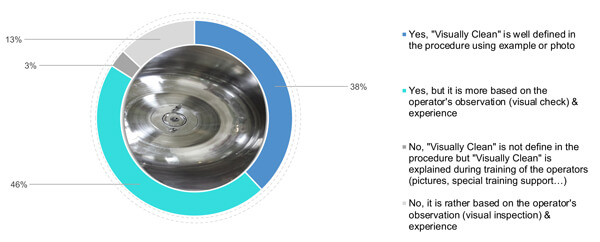
Figura 3 Sua empresa define e detalha o significado dos critérios de “visualmente limpo”?
Os operadores que realizam inspeção visual requerem formação específica porque o que se pode ver visualmente varia com a distância, o ângulo, a iluminação, a natureza da superfície, o nível de secura e a acuidade visual do inspetor (3, 7, 9). A EMA sugere que os testes de visão (ou acuidade visual) sejam realizados periodicamente e que a competência do operador seja comprovada por meio de uma avaliação prática (3). O Mapa de Riscos do ISPE sugere que: «Em situações em que o método de detecção é apenas visual, é importante entender a acuidade visual da equipe e o nível de resíduo que é considerado seguro» (7). Se o nível de segurança estiver abaixo da acuidade visual da equipe, o risco da falha não ser detectada pode ser considerado alto, enquanto que se o nível de segurança estiver bem acima (várias ordens de magnitude) da acuidade visual da equipe, o risco da falha não ser detectada pode ser considerado baixo.
A frequência do teste de acuidade visual e do limite de acuidade visual dependeria de variáveis específicas, como:
- distância entre o inspetor e a superfície do equipamento inspecionado (3, 7, 12)
- configuração do equipamento e natureza da superfície (7,8)
- condições de iluminação do ambiente (3, 7, 9, 12)
- frequência dos testes analíticos (3, 7-9, 11,12)
- toxicidade dos resíduos, limite de limpeza versus limite de detecção visual (3,6,7)
- a inspeção visual é realizada apenas para confirmar a limpeza de um equipamento (7)
trinta e oito por cento dos entrevistados não exigem certificação ou qualificação do operador (Figura 4). No entanto, 49% formam seus operadores para limpar visualmente em campo (em frente ao equipamento). Por fim, 13% qualificam seus operadores.
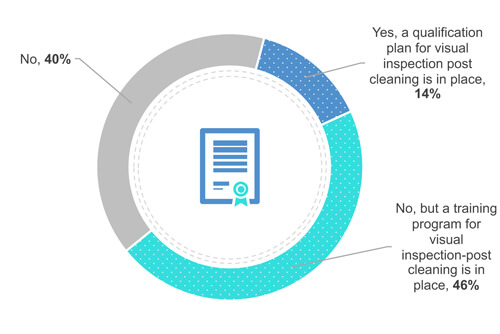
Figura 4 Sua empresa possui um programa de certificação ou qualificação para inspeção visual?
Alguns fabricantes definiram o limite de resíduo visual com o uso de cupons que um operador poderia detectar (13, 14). Além disso, alguns deles simularam a distância entre o operador e as superfícies a serem inspecionadas no equipamento de processo (15, 16). Quando o limite de resíduo visual for inferior ao limite de limpeza, a inspeção visual por si só, como critério de aceitação, pode ser suficiente (7).
Uma certificação ou qualificação, juntamente com um programa de formação, garante a competência dos operadores para inspecionar visualmente uma superfície? Seguindo o preceito do ICH Q9: Gestão de riscos de qualidade (17), a resposta geralmente dependeria de:
- número de desvios históricos de inspeção visual devido a formação do operador
- dificuldade em inspecionar o equipamento (configuração do equipamento e ambiente de fundo, como iluminação, ângulo etc.) (3, 7–9, 11, 12, 18, 19)
- tipo de inspeção visual utilizada; inspeção visual qualitativa ou quantitativa (7,12, 13–16, 18,19)
- a inspeção visual não é complementada com testes analíticos (13–16,18)
- frequência dos testes analíticos realizados com a inspeção visual
- sensibilidade do método analítico em relação ao limite de limpeza, toxicidade (com base no limite de exposição baseado na saúde) dos resíduos (1–7, 9,11)
- presença de uma verificação dupla
Conclusão
O conceito de inspeção visual e os critérios de “limpeza visual” parecem variar entre os fabricantes europeus com base em suas experiências com a execução do processo de limpeza e compreensão dos requisitos regulatórios. No entanto, os critérios de limpeza visual devem ser claramente definidos nos procedimentos. Os operadores que realizam inspeção visual precisam de formação específica, que pode ser baseada em suas próprias experiências.
Conforme sugerido pelos resultados da pesquisa, a variabilidade nas práticas entre os fabricantes pode ser aceitável quando o risco é documentado. Seguindo os preceitos do ICH Q9, o nível de esforço e a formalidade devem ser compatíveis com o risco do paciente.
Na Parte II, será apresentado um estudo de caso e um requisito mínimo sugerido para inspeção visual de superfícies limpas.
Visual Inspection Practices of Cleaned Equipment: Part II
Os fabricantes europeus interpretam os critérios de “visualmente limpo” de várias maneiras, com base em suas experiências na execução do processo de limpeza e em suas próprias interpretações dos requisitos regulamentares (1). Ainda assim, um programa formal de formação e qualificação em inspeção visual, bem como instruções, devem ser estabelecidos para evitar o risco de contaminação e verificar se o equipamento está limpo com base em um conjunto de controles do fabricante (2).
A variabilidade nas práticas entre os fabricantes é aceitável. No entanto, os operadores devem ser formados e qualificados periodicamente sobre quando inspecionar visualmente o equipamento limpo e como distinguir entre resíduos de produto e imperfeições da superfície que podem afetar os critérios de limpeza visual. O estudo de caso abaixo ilustra por que isso é importante.
Estudo de caso: observação de inspeção na inspeção visual
Recentemente, os inspetores da FDA dos EUA entregaram uma observação a um fabricante biofarmacêutico anônimo sobre critérios de «visualmente limpo». Durante uma visita ao chão de fábrica da empresa, um dos inspetores verificou a sala a montante, onde estavam localizados dois tanques de fermentação. Os recipientes fazem parte de um sistema fechado e são limpos usando um sistema de limpeza no local (CIP [clean-in-place]) totalmente automatizado. O ciclo de CIP de um dos fermentadores terminou uma hora antes do inspetor entrar na sala a montante. O inspetor olhou para dentro do recipiente através do visor, observou algumas gotas de condensação e notou que as superfícies não estavam brilhantes. Isso não convenceu o inspetor de que o recipiente estava “visualmente limpo” (Figura 1).

Figura 1 Algumas impressões digitais químicas (vestígios de descoloração) detectadas na superfície interna do fermentador
Isso levou à seguinte observação: «Descoloração observada no fermentador (ID do equipamento XXXX). Essa questão específica não foi avaliada pela empresa. Este fermentador é usado para fermentação de [nome do produto]». [Nota do editor: as citações são do documento regulatório resultante].
Essa observação levantou muitas questões e impactou diversas estratégias de controle. Como isso ocorreu após um ciclo de limpeza em que uma inspeção visual sistemática (de rotina) foi realizada, isso afetou a estratégia de controle de limpeza e o programa de manutenção em vigor para garantir que as superfícies dos recipientes estivessem em condições aceitáveis. Esses dois programas não estavam alinhados sobre como inspecionar e gerenciar recipientes. O que poderia ser mais prático do que uma inspeção visual diária para confirmar um estado aceitável da superfície antes de confirmar o status visualmente limpo?
A empresa biofarmacêutica conseguiu justificar a presença de gotículas após a conclusão do processo de CIP como aceitável, principalmente porque o tempo de espera limpo (CHT [clean hold-time]) foi validado com sucesso em condições limpas semelhantes. O inspetor entendeu a situação (que o equipamento foi observado imediatamente após o processo de CIP) e aceitou a justificativa.
Em relação à descoloração na parede do recipiente, também houve uma explicação. Diversas condições podem gerar descoloração do aço inoxidável quando este entra em contato com produtos específicos, agentes químicos ou efeitos térmicos. Isso é conhecido como efeito de intemperismo interno da superfície. A mudança na superfície pode alterar a condição de inspeção visual, o que pode alterar a decisão do inspetor (ou operador) sobre se a superfície está visualmente limpa, mesmo que o fabricante tenha um processo de formação e qualificação de alta qualidade.
A observação em si é clara: a “descoloração… não havia sido avaliada” enquanto o equipamento estava sendo usado rotineiramente para produzir produtos biológicos em massa. No entanto, não se referiu a uma exigência específica.
Como a empresa respondeu a essa observação?
- A empresa reconheceu que a descoloração da superfície foi detectada durante a inspeção da FDA e não havia sido avaliada antes da inspeção.
- Uma ação imediata foi implementada para investigar a descoloração, amostras foram coletadas para análise e o fermentador não foi utilizado.
A investigação demonstrou que a descontaminação dos recipientes usando agentes químicos cáusticos ou outros agentes em altas temperaturas (maiores que 100 °C) causava tensão nas paredes dos recipientes e podia causar o aparecimento de uma reação química nas superfícies de aço inoxidável. O eletropolimento restaura apenas temporariamente a superfície dos recipientes. De fato, os processos de descontaminação e limpeza geraram descolorações nas superfícies internas do fermentador desde então.
Há uma lição a ser aprendida com esta observação da FDA: O escopo da inspeção visual por um inspetor (por exemplo, operadores ou técnicos) após um processo de limpeza deve ser bem definido. Os processos de descontaminação e limpeza causam um impacto duradouro na estrutura do equipamento ao longo do tempo. Os processos implementados para limpeza, descontaminação e manutenção devem ser consistentes, alinhados e faseados. Portanto, a estratégia de controle de limpeza e manutenção deve ser capaz de abordar os seguintes desafios:
- Como avaliar e documentar as “imperfeições visuais” do material que constitui o equipamento
- Como definir adequadamente um nível de secura aceitável antes da inspeção visual
- Como formar inspetores (operadores, técnicos e especialistas no assunto) para a limpeza visual e imperfeições de superfície aceitáveis?
- Como definir uma imperfeição de superfície que levaria à desclassificação do equipamento
- Como determinar se o papel da inspeção visual deve incluir o controle de imperfeições da superfície?
Como inspecionar o status visualmente limpo
A maioria dos inspetores (operadores) em toda a indústria tem inspecionado e liberado equipamentos de fabricação com base na experiência (1,2). No entanto, distinguir resíduos de produtos e imperfeições de superfície pode ser difícil para os operadores.
Para resolver esse problema, os operadores devem ser formados em equipamentos construídos com os mesmos materiais e na mesma situação que apresentam os resíduos-alvo que eles devem detectar visualmente. O procedimento de formação e suporte para garantir a inspeção visual reprodutível devem conter, pelo menos, as seguintes seções:
1 Definição de critérios de visualmente limpo
Visualmente limpo, definido como “ausência de resíduos visíveis em uma superfície”, deve ser adequadamente definido como um critério de aceitação no procedimento.
Além das descrições, as imagens (Figura 2) de superfícies visualmente limpas em um procedimento ou curso de formação representam a melhor opção. A inspeção visual pode detectar muito mais do que resíduos de produto.
Estudos recentes demonstraram que formar o inspetor para diferenciar entre resíduos na superfície e imperfeições ou descolorações de superfície não críticas é importante para inspecionar visualmente as superfícies limpas (2, 3). Em alguns casos, os operadores podem ser informados sobre o nível de descoloração ou imperfeição aceitável nas superfícies, pois alguns consideram esse controle de superfície como parte do programa de manutenção ou engenharia.
O nível de secura aceitável do equipamento ou a categoria e as condições de drenagem podem fazer parte da definição ou podem ser incluídos em uma avaliação de risco de limpeza.

Figura 2 Superfícies visualmente limpas após um processo de limpeza
2 Escopo da inspeção visual
Quais superfícies devem ser visualmente inspecionadas? Todas as superfícies do equipamento que entram em contato direta ou indiretamente com o produto, material a granel ou intermediário devem ser visualmente inspecionadas. Como nem todas as superfícies de um equipamento podem ser visíveis para inspeção visual, o escopo pode ser adaptado ao tipo de equipamento. Deve ser discutido como e o que inspecionar visualmente na superfície.
3 Condições ambientais para inspecionar visualmente uma superfície limpa
As condições ao redor do equipamento a ser inspecionado visualmente afetam a capacidade de detectar resíduos adequadamente, tornando esse ambiente um elemento importante. A quantidade de resíduos detectáveis (limite de resíduo visível) depende do produto e precisa ser definida caso a caso ou pela abordagem de agrupamento (2–6).
Para confirmar o impacto das condições ambientais em uma inspeção visual, os seguintes fatores devem ser analisados:
Distância de visualização: a distância entre a superfície e o operador. Essa distância de visualização pode não ser fácil de simular em um laboratório. No entanto, o bom senso diz que quanto maior a distância, mais difícil pode ser a inspeção visual. A acuidade visual do inspetor a uma distância específica também desempenha um papel.
Níveis de luz (aproximadamente de 400 a 1500 Lux em salas limpas normais): Alguns estudos com cupons indicaram que níveis de luz entre 200 e 1400 Lux podem não alterar a inspeção visual de um inspetor; ainda assim, isso deve ser demonstrado por meio de situações reais.
Ângulo de visão: o ângulo de visão entre os olhos do inspetor e as superfícies a serem inspecionadas visualmente também deve ser considerado e integrado ao processo de inspeção visual. Dependendo dos ângulos e níveis de luz, um inspetor pode ver alguns reflexos que dificultariam a confirmação da limpeza visual.
Luz secundária: o uso de uma lanterna não é recomendado quando as execuções de validação de limpeza não foram inspecionadas com uma lanterna. As condições de inspeção devem ser semelhantes entre as execuções de validação e a limpeza e manutenção de rotina.
Entender os fatores ambientais que podem alterar a inspeção visual é fundamental para evitar decisões inadequadas.
4 Momento da execução da inspeção visual
Uma inspeção visual deve ser executada após a conclusão da operação de limpeza. Ao mesmo tempo, isso geralmente não faz parte da documentação e pode resultar em dúvidas sobre a execução da inspeção visual caso um ciclo de limpeza seja abortado. O procedimento deve especificar quanto tempo após o término do ciclo de limpeza uma inspeção visual deve ser realizada. Esse tempo deve ser determinado para garantir que o operador esteja seguro ao abrir um recipiente (por exemplo, a etapa de subida geralmente é realizada em altas temperaturas). Esse tempo afeta o processo de drenagem de água ou solvente e pode invalidar prematuramente a inspeção.
5 Metodologia de inspeção visual
Uma metodologia estruturada para inspecionar visualmente equipamentos limpos deve ser estabelecida. Por exemplo, um fabricante poderia desenvolver uma lista de verificação que identificasse as várias partes do equipamento a serem inspecionadas visualmente em um caminho visual coerente. Além de seguir o método de inspeção visual geral, alguns fabricantes desenvolveram listas de verificação que identificam peças específicas ou locais conhecidos de pior caso que devem ser inspecionados visualmente.
6 Identificação dos resíduos-alvo visíveis
Os operadores devem ser apresentados a todos os elementos que podem examinar durante a inspeção visual. Esses elementos podem incluir resíduos do produto, imperfeições da superfície, danos à superfície, água residual e partículas, entre outros.
O operador inspecionará as superfícies visíveis com todas as suas imperfeições. Eles também poderão detectar muitos outros elementos ou anomalias, começando por defeitos relacionados ao material, seu envelhecimento, vestígios de água residual, partículas e resíduos de produtos (Figura 3). Portanto, o alvo da inspeção visual e os critérios de aceitação devem ser claramente definidos.

Figura 3 Elementos que os operadores devem detectar em uma superfície de contato direto ou indireto com o produto
O nível de formalidade no desenvolvimento dessas seis seções depende das estratégias de controle e avaliação dos riscos de limpeza da empresa.
Conclusão
A inspeção visual é o método escolhido para confirmar o status visualmente limpo. A maioria dos inspetores (operadores) em toda a indústria tem inspecionado e liberado equipamentos de fabricação com base na experiência (1,3). No entanto, pode ser difícil para os operadores distinguir resíduos de produtos e imperfeições de superfície sem formação e qualificação adequadas. Consequentemente, faz sentido formar adequadamente os operadores e garantir que todos os materiais de construção e em situações semelhantes sejam oferecidos para detectar visualmente os resíduos-alvo e imperfeições de superfícies que podem afetar o status visualmente limpo. Um programa formal de formação e qualificação em inspeção visual, bem como instruções, deve ser estabelecido. Este programa deve ser baseado no conjunto de controles que o fabricante usa para verificar se o equipamento está limpo. Portanto, a inspeção visual, conforme definida e qualificada, pode ser um método de controle preliminar para uma estratégia de gerenciamento de riscos de limpeza.
Ambos os autores estiveram envolvidos na elaboração do manuscrito e aprovaram a versão final. O desenvolvimento deste artigo foi patrocinado pela GlaxoSmithKline Biologicals SA e STERIS. Os autores declaram o seguinte interesse: Walid El Azab é funcionário da STERIS e Stephane Cousin é funcionário do grupo de empresas GSK.
Referências da Parte 1
- European Commission, Good Manufacturing Practice Medicinal Products for Human and Veterinary Use: Annex 15, qualification and validation, 2015.
- Canada Health Products and Food Branch Inspectorate. Guidance Document. Cleaning validation guidelines: Drug and health products. Health Canada: Ottawa, Canada; 2002 Spring.
- European Medicines Agency, Questions and answers on implementation of risk-based prevention of cross-contamination in production and ‘Guideline on setting health-based exposure limits for use in risk identification in the manufacture of different medicinal products in shared facilities’ (EMA/CHMP/CVMP/SWP/169430/2012), EMA/CHMP/CVMP/SWP/246844/2018, (April 2018)
- European GMP part IV Guidelines on Good Manufacturing Practice specific to Advanced Therapy Medicinal Products
- Pharmaceutical Inspection Convention and Pharmaceutical Inspection Co-operation Scheme. Guide to Good Manufacturing Practice for Medicinal Products: Annex 15, 2015.
- Walsh A. et al., “Justification & Qualification Of Visual Inspection For Cleaning Validation In A Low-Risk, Multiproduct Facility.” Pharmaceutical Online (Aug. 3, 2018) accessed January 2020 https://www.pharmaceuticalonline.com/doc/justification-qualification-of-visual-inspection-for-cleaning-validation-in-a-low-risk-multiproduct-facility-0001
- ISPE, ISPE Risk-Based Manufacture of Pharmaceutical Products, second edition, Volume 7
- Active Pharmaceutical Ingredients Committee, guidance on aspects of cleaning validation in active pharmaceutical ingredient plants (2016)
- Parenteral Drug Association, Technical Report 29, Points to Consider for Cleaning Validation (2012)
- GUIDE TO INSPECTIONS VALIDATION OF CLEANING PROCESSES, accessed on September 2019: https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/inspection-guides/validation-cleaning-processes-793
- Parenteral Drug Association, Technical Report 49, Points to Consider for Biotechnology Cleaning Validation (2010)
- ASTM: E306-18, Standard guide for Science-Based and Risk-Based Cleaning Process Development and Validation, October 2018 version 1.
- Forsyth, R.J., et al. “Visible-Residue Limit for Cleaning Validation and its Potential Application in a Pharmaceutical Research Facility.” Pharmaceutical Technology 28 (Oct. 1, 2004) 68–72.
- “Application of Visible-Residue Limit for Cleaning Validation.” Pharmaceutical Technology 28 (Oct. 2, 2005) 10 http://www.pharmtech.com/application-visible-residue-limit-cleaning-valiation?id=&pageID=1&sk=&date= (accessed September 2019)
- “Determination of Surface Visible Residue Limits on Pharmaceutical Plant Equipment.” Pharmaceutical Technology 37 (Feb. 2, 2013)
- Desai, P., and Walsh, A. “Validation of Visual Inspection As An Analytical Method For Cleaning Validation.” Pharmaceutical Online (Sept. 11, 2017) https://www.pharmaceuticalonline.com/doc/validation-of-visual-inspection-as-an-analytical-method-for-cleaning-validation-0001 (accessed September 2019)
- International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for human use, Quality Risk Management Q9, (2005)
- Walsh, A., et al., “Justification & Qualification Of Visual Inspection For Cleaning Validation In A Low-Risk, Multiproduct Facility.” Pharmaceutical Online (Aug. 3, 2018) https://www.pharmaceuticalonline.com/doc/justification-qualification-of-visual-inspection-for-cleaning-validation-in-a-low-risk-multiproduct-facility-0001 (accessed January 2020)
- Forsyth, R.J., and Hartman, J., “A Risk-based Approach to Cleaning Validation using Visible Residue Limits.” Pharmaceutical Engineering 28 (2008) 8–22.
Referências da Parte 2
- El Azab W. and Cousin S., “Visual Inspection Practices of Cleaned Equipment: Part I,” accessed April 2020: https://www.pda.org/pda-letter-portal/home/full-article/visual-inspection-practices-of-cleaned-equipment-part-i
- Walsh, A., et al., “Justification & Qualification of Visual Inspection for Cleaning Validation in a Low-Risk, Multiproduct Facility.” Pharmaceutical Online (Aug. 3, 2018) https://www.pharmaceuticalonline.com/doc/justification-qualification-of-visual-inspection-for-cleaning-validation-in-a-low-risk-multiproduct-facility-0001
- Desai, P. and Walsh, A. “Validation of Visual Inspection as an Analytical Method for Cleaning Validation.” Pharmaceutical Online (Sept. 11, 2017) https://www.pharmaceuticalonline.com/doc/validation-of-visual-inspection-as-an-analytical-method-for-cleaning-validation-0001
- Forsyth, R.J., et al. “Visible-Residue Limit for Cleaning Validation and its Potential Application in a Pharmaceutical Research Facility.” Pharmaceutical Technology 28 (Oct. 2004): 58–72 https://pdfs.semanticscholar.org/ea64/d01db84d3b8a5a62f1c824abf8484af363dd.pdf
- “Application of Visible-Residue Limit for Cleaning Validation.” Pharmaceutical Technology 29 (Oct. 2, 2005) http://www.pharmtech.com/application-visible-residue-limit-cleaning-validation?id=&pageID=1&sk=&date=
- “Determination of Surface Visible Residue Limits on Pharmaceutical Plant Equipment,” Pharmaceutical Technology (Feb. 2, 2013) 37 http://www.pharmtech.com/determination-surface-visible-residue-limits-pharmaceutical-plant-equipment?id=&pageID=1&sk=&date=
Conteúdo sugerido
Um processo justificado para limpeza e desinfecção
Serviços a considerar ao validar seu equipamento
Preservação do aço inoxidável: mitigação do rouge
Cadastre-se em nossa lista de e-mails para receber as últimas notícias do setor e atualizações de produtos.
Ao clicar em Inscrever-se, você confirma que concorda com nossos Termos e Condições.



