Colaboração entre STERIS VHP e ChargePoint: Estudo de caso da Ritedose Corporation
Principais conclusões:
- A Ritedose usou a válvula ChargePoint AseptiSafe® Bio com o sistema STERIS VHP™ para transferência estéril de pó em uma sala limpa de grau C, evitando melhorias despendiosas de infraestrutura.
- Uma redução validada de 6 logs foi alcançada por meio de um ciclo de quatro fases (desumidificação, condicionamento, descontaminação e arejamento), garantindo a esterilidade no ponto de transferência.
- A solução integrada eliminou a necessidade de isoladores ou RABS, reduzindo custos, uso de energia e complexidade.
- Os métodos de validação incluíram indicadores químicos e biológicos, preenchimentos de meios e estudos de retenção estéril.
- O sistema melhorou a eficiência do processo, a garantia de esterilidade e a ergonomia, demonstrando benefícios escaláveis para a fabricação farmacêutica.
The Ritedose Corporation é uma organização norte-americana de desenvolvimento e fabricação por contrato (CDMO) que produz produtos estéreis em dose unitária.
A Ritedose é uma empresa farmacêutica de serviço completo que utiliza a tecnologia blow-fill-seal. Suas capacidades vão muito além da fabricação, com uma equipe de desenvolvimento interno especializada em todos os aspectos de colocação de um produto no mercado, como lotes em escala de laboratório, registros regulatórios, fabricação em escala e distribuição. A empresa conta com mais de 20 anos de experiência na produção de produtos respiratórios e oftálmicos e uma instalação com capacidade para 1,7 bilhão de unidades, utilizando a mais recente tecnologia em formulação, blow-fill-seal e embalagem em alta velocidade.
Desafio
A Ritedose Corporation estava procurando resolver o problema de carregar IFA estéril em um tanque de mistura. Este é um problema comum com todos os produtos farmacêuticos preparados assepticamente.
Era essencial para o processo manter condições estéreis ao acoplar um recipiente no receptáculo e então transferir o IFA sólido para formar uma suspensão líquida. Com o líquido totalmente dissolvido, o produto pode ser filtrado de forma estéril para garantir a esterilidade ao ser passado para a envasadora. Neste caso, embora o produto que estava sendo passado para a envasadora fosse uma suspensão, esta opção não era possível.
Isso exigia que todo o processo fosse realizado em condições assépticas e, como tal, normalmente significaria que uma das seguintes melhorias seria necessária.
1. Melhorar toda a sala, de uma sala limpa de grau C para grau A.
2. Melhorar a sala para um ambiente de grau B e, adicionalmente, introduzir uma área de grau A superpressurizada ao redor do ponto de envase.
3. Melhorar a sala para um ambiente de grau B e, adicionalmente, introduzir um sistema RABS no ponto de envase ou de receptáculo cheio.
4. Manter a sala limpa de grau C, mas introduzir tecnologia de isolador ao redor do ponto de envase ou receptáculo cheio.
Tradicionalmente, RABs e a tecnologia de isoladores teriam sido favorecidos aqui devido aos benefícios que trazem em termos de melhor garantia de esterilidade, empregando técnicas fundamentais de separação e descontaminação. Dito isto, ao considerar algumas das restrições negativas que vêm com essas tecnologias, como alto investimento de capital inicial, espaço, ergonomia e custo e consumo de energia contínuos, a empresa decidiu procurar em outro lugar uma solução mais adequada para essa tarefa crítica.
Solução
Um produto asséptico de válvula biológica foi selecionado como solução ideal para esse problema, proporcionando uma transferência de pó vedada em um espaço pequeno, montado na porta de entrada do receptáculo. A válvula pode ser pré-esterilizada a vapor junto com o receptáculo, diferentemente de SBVs tradicionais ou outras conexões convencionais (veja a ilustração 1a/b). Na conexão final, a solução também removeu qualquer contaminação do ambiente das faces de acoplamento da transferência de maneira controlada e validada (veja a ilustração 2a/b).

Ilustração 1a - Tampa do Dock SIP

Ilustração 1b - SIP através da tampa – pré-esterilização ativa e receptáculo
Transferência estéril de IFA
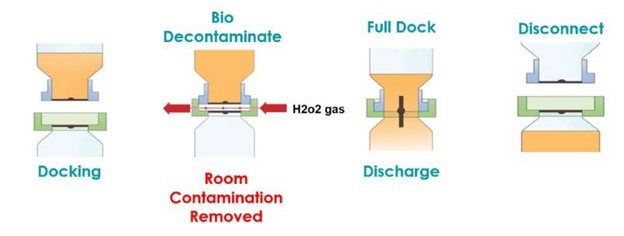
A válvula biológica AseptiSafe funciona criando uma câmara vedada entre o recipiente de transferência (seção passiva) e o receptáculo (seção ativa). Quando as duas metades se encaixam, a câmara vedada é então biodescontaminada com um sistema de biodescontaminação de peróxido de hidrogênio vaporizado STERIS, VHP®.
Ilustração 2a
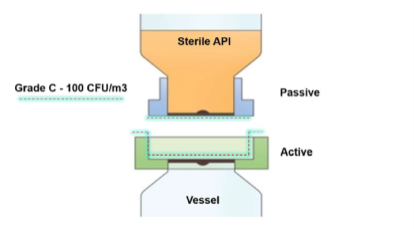

A unidade STERIS VHP remove qualquer contaminação biológica, com uma redução validada de 6 logs, e deixa o espaço e as faces de acoplamento descontaminados e prontos para o encaixe completo. Uma vez acoplado, o disco pode ser aberto, o que permite que o produto seja transferido do recipiente de transferência para o receptáculo, sem risco de contaminação. Realizar essa transferência ainda dentro do espaço de grau C proporcionou enormes benefícios de custo e produção, embora o processo precisasse ser totalmente validado para garantir que os benefícios iniciais percebidos pudessem ser comprovados.
Ilustração 2b
Validação
O primeiro passo na validação microbiológica do processo foi gerar um ciclo de descontaminação validado para a fase de gaseificação de peróxido de hidrogênio. O processo seco e gasoso do STERIS VHP consiste em quatro fases distintas, pelas quais o gerador passará para garantir que todas as condições críticas sejam atendidas e que um ciclo validado seja realizado a cada vez. Todas as quatro fases são definidas no prazo.
1 Desumidificação – a válvula é gaseificada e reduz a umidade dentro da câmara para fornecer condições ideais para a eliminação biológica.
2 Condicionamento – o VHP é introduzido na válvula para acumular níveis que permitam uma boa descontaminação.
3 Descontaminação – A concentração de VHP é mantida para eliminar qualquer atividade microbiológica dentro da válvula.
4. Arejamento – quando a descontaminação biológica é concluída, o VHP é removido do sistema para que não haja níveis prejudiciais de resíduos. Normalmente, o nível de aceitação é de 1 ppm, embora neste caso tenha sido usado 0,4 ppm como nível de aceitação. A Ritedose usou um limite de resíduos mais baixo para garantir que tivesse um sistema robusto e nenhuma chance de contaminação do produto devido a resíduos de gás.
O ciclo completo de descontaminação pode ser realizado em apenas quatro minutos, embora 20 minutos seja o tempo mais comum. Para esta aplicação, o processo estava sendo executado apenas uma vez por dia e, para garantir que um ciclo robusto fosse produzido, tempo adicional foi adicionado a cada uma das fases críticas, garantindo que a descontaminação fosse confirmada e o gás fosse aerado do sistema. Isso resultou em um ciclo completo de 41 minutos (condicionamento para arejamento).
| Parâmetro/Fase | Desumidificação | Condicionamento | Descontaminação | Arejamento |
Tempo, minutos | (10) | (0) | (6) | (25) |
Os ciclos iniciais utilizaram indicadores químicos (CIs) para determinar a distribuição de H202. Quando resultados satisfatórios de CI foram alcançados, indicadores biológicos (BIs) foram introduzidos no processo para confirmar que o processo foi alcançado com sucesso. Após a conclusão de cada ciclo, todos os BIs e CIs foram coletados. As tiras de CI foram então verificadas quanto à mudança de cor para garantir uma distribuição uniforme do vapor. Os BIs foram transferidos para um meio de crescimento adequado, neste caso, o meio de cultura Spordex® e incubados de 55 °C a 60 °C por sete dias. Eles foram observados diariamente para verificar qualquer crescimento microbiano.

Os critérios de aceitação do ciclo incluíam:
A) Todas as tiras de CI utilizadas no ciclo devem ter mudado de cor.
B) O BI de controle positivo deve demonstrar crescimento.
C) Pelo menos um BI de cada local não deve demonstrar crescimento.
Depois que o ciclo foi desenvolvido, ele foi executado em triplicado para formar a qualificação de desempenho (PQ) para esse elemento do processo.
Para validar completamente o sistema, o processo foi desafiado com diversas execuções de meio antes da validação. Esses desafios de meio bem-sucedidos foram levados adiante com três execuções de meio no PQ. A retenção estéril foi demonstrada por mais de 10 dias com o produto transferido para o receptáculo e com a válvula biológica mantida na posição fechada e intertravada. O período de espera estéril foi demonstrado para a seção passiva (produto no recipiente de transferência) por 48 horas, o que foi mais do que adequado, pois normalmente seria, no máximo, metade desse tempo.
Conclusão
A instalação agora está operacional e em plena produção. Os benefícios originais observados no início do projeto, como baixo custo de capital para equipamentos, menor área ocupada e facilidade de instalação, agora foram acompanhados por melhor garantia de esterilidade, facilidade de uso para operadores e baixa manutenção. O sistema é simples de usar, fácil de instalar/validar e certamente melhorou o processo da empresa.
Um aprendizado deste projeto foi na fase de dispensação. No momento da validação, o sistema instalado era uma solução reutilizável totalmente rígida, onde o IFA pré-esterilizado era fornecido à Ritedose em sacos. Esses sacos foram abertos, subdivididos e dispensados dentro de um isolador asséptico para o recipiente de transferência pré-esterilizado e para a seção passiva da válvula biológica. Teria sido benéfico esterilizar o produto, o recipiente e a conexão de transferência em uma única etapa (irradiação gama), embora, devido às restrições associadas à esterilização com raios gama de conjuntos de aço inoxidável e elastoméricos como um único item, isso não foi possível.
Esta solução agora está disponível na ChargePoint na forma de um Single Use Passive (SUP)/ChargeBag® e, no futuro, poderá ser adotada para melhorar e agilizar o processo, por meio do qual todo o pacote (saco e passivo) pode ser enviado para esterilização com raios gama, em vez de ter várias etapas individuais de esterilização e montagem asséptica.
“Era fundamental escolher a solução certa para este projeto com a finalidade de evitar a contaminação e perdas dispendiosas de produto. Selecionamos a válvula de transferência ChargePoint AseptiSafe® Bio devido à sua maior garantia de esterilidade ao manusear ingredientes sensíveis, como nosso princípio ativo. Recebemos suporte considerável durante o projeto, e estamos nos beneficiando de reduções significativas de custos e eficiências de processo.”
Angie Koen, vice-presidente de serviços técnicos da The Ritedose Corporation.
Conteúdo sugerido
Guia para a implementação de um sistema de VHP para biodescontaminação de instalações
Seleção da tecnologia de descontaminação: aerossolizado vs. VHP
As vantagens da descontaminação com o peróxido de hidrogênio vaporizado
Cadastre-se em nossa lista de e-mails para receber as últimas notícias do setor e atualizações de produtos.
Ao clicar em Inscrever-se, você confirma que concorda com nossos Termos e Condições.



